新闻资讯
新闻资讯
联系我们
手机:19314072625
电话:400-172-8090
邮箱:kxwlhg@163.com
地址:合肥市蜀山区望江西路5089号科大先进技术研究院智源楼
微化知识
羰基-光氧化还原/过渡金属双催化研究进展
- 作者:科芯微流
- 发布时间:2023-09-22
- 点击:707
摘要:
羰基-光氧化还原/双金属催化的有机转化近年来备受关注。丰富且廉价的羰基光敏剂可有效地用作单电子、能量或氢原子转移剂,以诱导金属催化的烯烃交叉偶联和双官能化。本文综述了2020年至2023年金属催化剂参与的光催化偶联反应的文献报道,重点是C-C (C(sp3)-C(sp3),C(sp3)-C(sp2),C(sp2)-C(sp2), C(sp2)-C(sp))和C-杂原子(C(sp3)-S,C(sp3)-N,C(sp2)-O, C(sp2)-S,C(sp2)-P, C(sp2)-B)的成键反应。
Abstract:
Organic transformations using carbonyl-photoredox/metal dual catalysis have attracted much attention in recent years. Abundant and inexpensive carbonyl photosensitizers effectively serve as single electron, energy or hydrogen atom transfer agents to induce metal-catalyzed cross-coupling and dicarbofunctionalization of olefins. This review covers literature reports of metal-catalyzed photocatalytic coupling reactions from 2020 to mid-2023, with a focus on C-C (C(sp3)-C(sp3),C(sp3)-C(sp2),C(sp2)-C(sp2), C(sp2)-C(sp)) and C-heteroatom (C(sp3)-S,C(sp3)-N,C(sp2)-O, C(sp2)-S,C(sp2)-P, C(sp2)-B)bond forming reactions.
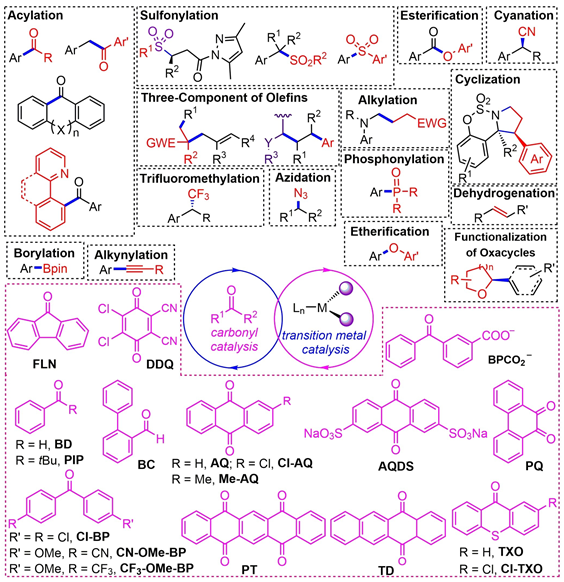
1.引言
近年来,由于MacMillan,Xiao,Molander及其同事等人的开创性研究,光氧化还原/过渡双金属催化已经成为促进C-C和C-杂原子成键的强效而又温和的合成策略。这项工作的灵感来自钌基(Ru)和铱基(Ir)的光氧化还原催化反应。然而,由于Ru和Ir价格昂贵,低成本,低毒性的有机染料的反应范围又比较局限。使得开发具有广泛氧化还原能力且易于合成的廉价的有机光催化剂是非常有前景的。
芳香羰基光催化剂因其相对较低的成本、易于获得和易于结构操作而得到了广泛的研究。在光照射下,由非键合轨道(n,π*)激发电子,然后进行系间窜跃(ISC)产生长寿命三重激发态羰基,以促进氢原子转移(HAT),单电子转移(SET)和能量转移(EnT)(图1)。因为羰基自由基具有较高的键解离能(BDE),并且羰基的激发态具有相对较高的氧化电位和三重态能,所以实现的可能性较大。
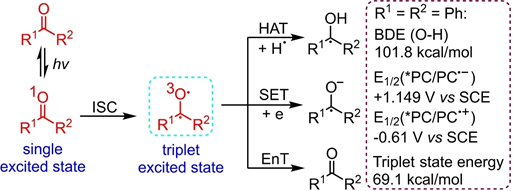
图1 羰基的激发
本文综述了2020年至2023年的文献报道,详细总结了羰基-光催化与过渡金属催化在有机合成中的结合。按有机反应类型排列,并详细说明每种方法的范围、局限性和机理。
2.酰化
使用α-氧代羧酸或醛作为酰化资源,通过金属催化活化C−H键实现芳烃的酰化,是形成芳基酮的一种有效合成方法。然而,这类反应需要较高的温度或过量的氧化剂。最近,在光照条件下通过光催化产生酰基自由基,已被确定为芳烃酰化得到芳基酮更加温和的替代图。
2.1.醛类酰化试剂
2020年,Zheng及其同事提出了一种Pd催化的醛C−H键直接芳基化和烯烃化方法,以蒽醌(AQ)为HAT光催化剂得到一系列酮(图2)。其中,溴苯与多种烷基醛的交叉偶联反应收率良好。4-甲氧基苯甲醛是一种相容的底物,但收率较低。对于具有一系列官能团(包括富电子基团和缺电子基团)的芳基溴被容纳在该系统中。其中,2-溴萘和杂芳族溴的收率令人满意。此外,二萜药物分子也提供了预期的酰化产物,收率为62%。
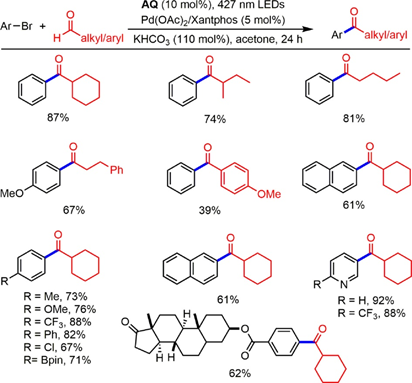
图2 直接醛C−H芳基化和烯基化通过合并AQ和钯催化合成酮
密度泛函理论计算表明,该光催化反应包括芳基卤的氧化加成、捕集酰基自由基以及Pd0催化剂和AQ再生还原消除。如图3所示,AQ(AQ*)的激发态可以转移甲酰基氢,得到酰基自由基(2)和[AQ-H]*。PdII中间体(4),由Pd0催化剂(3)与芳基卤化物氧化加成,捕集2得到aPdIII物种(5),然后还原消除,形成所需产物和PdI物种(6)。最后,KHCO3从6和从[AQ- H]*得到一个质子形成(3)和AQ,完成钯催化循环和光催化循环。
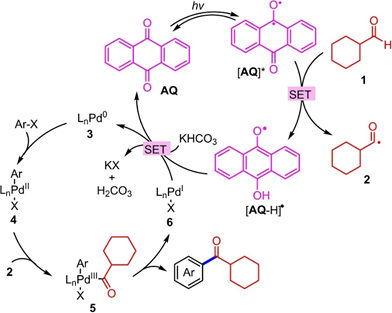
图3 提出了AQ与Pd催化融合直接醛C−H芳基化反应的机理
随后,Xia的小组报告了醛和芳烃偶联的酰化图,涉及菲醌(PQ)和钯催化的组合,使用氧化剂Ag2O,在蓝光LED照射下(图4)。以2-苯基吡啶为反应伙伴,将各种取代的苯甲醛顺利转化为目标产物。1-萘甲醛相容,使预期产物的收率为87%。噻吩- 3 -甲醛是该反应的合适的偶联试剂,使芳基酮的产率为81%。当使用脂肪族醛作为底物时,得到中等的产率。2-苯基吡啶类衍生物具有Me、OMe和Br基团的产物有54-88%的产率。在苯基环的对位处用含醛基、甲氧基或苯基的醛处理苯并[h]喹啉衍生物,以中等收率得到了所需的偶联产物。
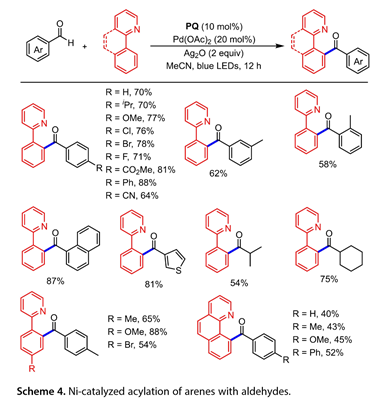
图4. 镍催化芳烃与醛的酰化反应
Stern-Volmer淬灭和自由基捕获实验表明,光催化剂与醛之间通过HAT过程生成酰基自由基。基于这些结果,提出了芳烃酰化反应的合理机制(图5)。PQ(PQ*)的激发态可以从醛(7)中提取一个氢,从而获得酰基自由基(8)和[PQ H]*。然后,[PQ H]*和Ag2O之间的单个电子转移再生光催化剂。同时,由2-苯基吡啶与Pd(OAc)2反应生成的PdII配合物(9)与酰基自由基反应,然后与Ag2O结合完成(ppy)PdIV(OAc)2(TolCO)中间体(10)氧化。最后,还原消除(10)得到所需的产品和Pd(OAc)2。
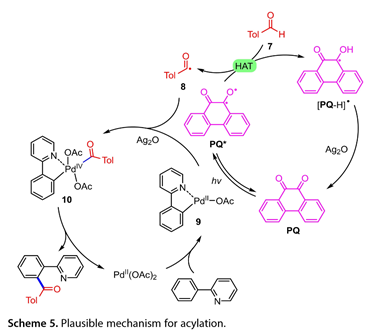
图5. 可能的酰化机制
最近,Wu小组报道了一种新方法,该方法在Co(dmgH)2pyCl(5mol%; dmgH=二甲基乙二醛肟; py=吡啶)存在下,在二氯甲烷(DCM)中,在360nm光下反应24h (图6),通过醛的直接激发得到一系列取代的芴酮,而无需添加光催化剂。当芳环被替换为C-4'位置的给电子基团或吸电子基团。间位二取代的[1,1'-联苯]-2-甲醛以1:1.2的比例生产出两种异构环化产物的混合物,总收率为86%。2'-(三氟甲基)-[1,1'-联苯]-2-甲醛也得到了34%的成品。这种光催化反应耐受杂环芳烃,尽管产率为25%。氧杂蒽酮和硫杂蒽酮衍生物可以在这种最佳反应条件下生成,同样具有中等产率。
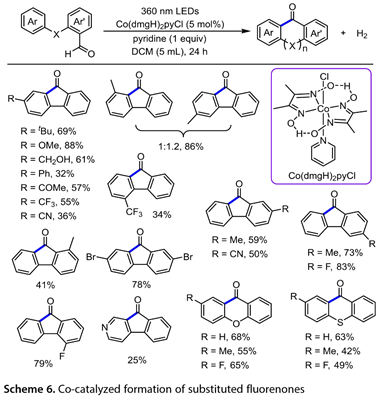
图6. Co催化取代芴酮的形成
电子顺磁共振和自由基消除实验表明该反应中产生了甲酰基自由基。动力学同位素效应测量表明,C键切割不能决定速率。提出的机理(图7)涉及360 nm光照射生成[1,1'-联苯]-2-甲醛在激发态(11)中,从而减少Co(III)配合物以产生自由基阳离子(12)和Co(II)中间体。然后(12)失去一个质子以传递酰基自由基(13),该自由基可以与芳烃进行分子内自由基加成以得到(14)。然后,Co(II)中间体可以捕获(14),以提供C-Co(III)物种(15)。β-H消除(15)产生所需的芴酮。
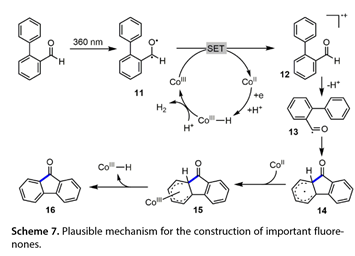
图7. 为构建重要的芴酮类化合物提供了可能的机理
2.2. α-酮酸作为酰化试剂
α-酮酸也已通过相应的羧酸盐和光催化剂之间的SET用于自酰化试剂[17]。在45W紧凑型荧光灯(CFL)的照射下,通过2-氯硫杂环-9-酮(Cl TXO)和镍催化剂的组合,将α-酮酸和芳基卤化物脱羧交叉偶联制备了多种酮(图8)。带有吸电子基团的芳基溴与苯乙醛酸的反应导致脱羧芳基化产物的形成。2-溴萘也经历了这种转变。杂芳基卤化物1-(6-溴吡啶-2-基)-乙基-1-酮耐受性良好,收率为80%。此外,包括取代苯基乙醛酸、脂肪族酮和2-(呋喃-2-基)-2-氧代乙酸在内的一系列α-氧代酸是该反应的合适底物,产物的产率为44-93%。据指出,缺电子的芳基碘化物比相应的芳基溴具有更高的反应活性。
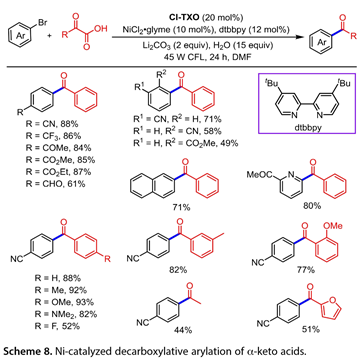
图8. 镍催化α -酮酸的脱羧芳基化反应
光催化活性与光催化剂的激发态氧化电位有关(图9)。Stern-Volmer淬灭和自由基捕获实验表明,SET从α-酮酸到Cl-TXO*是可能的,并证实了异丙酰自由基中间体的生成。
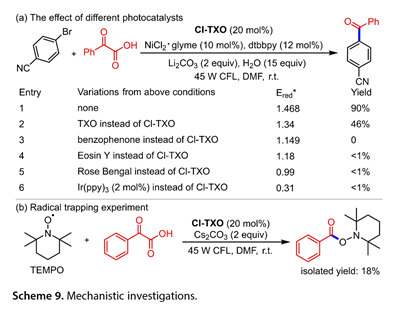
图9. 机理研究
图10概述了所提出的反应途径。Cl-TXO(Cl-TXO*)和α-氧代酸的激发态之间可能发生SET,产生羧基自由基(RCOCO2*)和酮基自由基阴离子[Cl-TXO]*。前者可以释放CO2以产生酰基自由基(RCO*,17),然后被LnNiII(Ar)X(19)捕获,LnNiII(Ar)X(19)由ArX氧化加成LnNi0(溶剂)(18)产生,生成Ni(III)中间体LnNiIII(Ar)(RCO)X(20)。随后,(20)进行还原消除以产生所需的酮和LnNiIX(21)。最后,介于(21)和[Cl-TXO]*之间的SET关闭循环,再生催化剂Cl-TXO和(18)。此外,Cl-TXO可用作α-氧代羧酸与烯烃脱羧交联的高效光氧化还原催化剂,以产生多种酮(图11)。在芳环上含有不同官能团的2-芳基乙醛酸也显示出良好的反应活性。各种α,β-不饱和酮不适合作为该转化的底物。
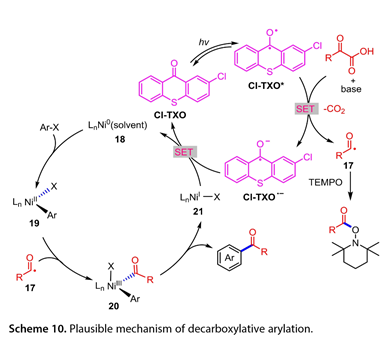
图10. 脱羧芳基化的可能机理
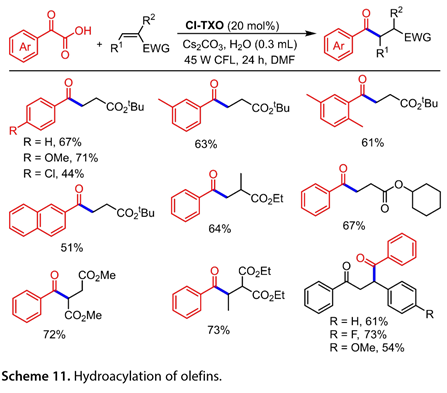
图11. 烯烃的氢酰化反应
激发后,光激发的Cl-TXO(Cl-TXO*)氧化脱羧酸盐α-酮羧酸盐以生成酰基自由基(17)和酮基自由基阴离子[Cl-TXO]*(图12)。加入酰基自由基托烯烃生成烷基自由基(22)。从[Cl-TXO]*到中间体(23)的SET然后是原生化,提供所需的产物并再生Cl-TXO光催化剂。
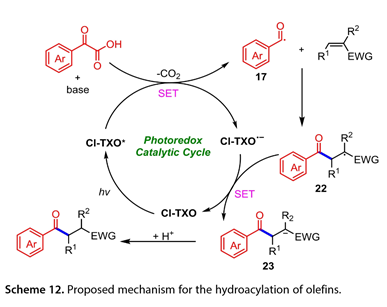
图12. 烯烃氢酰化反应的机理
2.3. N-酰基琥珀酰亚胺作为酰化试剂
2021年,罗和他的同事报道了一种通过N-酰基琥珀酰亚胺和甲基苯的交叉偶联合成芳香族酮的有效方法。在20W 365 nm LED照射下,将4,4'-二氯二苯甲酮(Cl-BP)(20 mol%)、NiCl2·glyme(5mol%)、dtbbpy(5mol%)、2,6-二甲基吡啶(2equiv)和甲苯及其衍生物(5mL)的混合物搅拌12h,各种N-酰基琥珀酰亚胺与甲基苯衍生物反应来得到所需产物(图13)。甲苯与N-酰基琥珀酰亚胺在苯基环的对位上反应,形成偶联产物(产率为56-72%)。缺电子的N-酰基琥珀酰亚胺耐受性良好,尽管产量较低。空间位阻效应影响了转化,获得了48-67%的产率。甲苯处理1-(3-苯基丙酰基)-吡咯烷-2,5-二酮得到C(sp3)卤化产物,收率38%。此外,对二甲苯或间二甲苯与N-酰基琥珀酰亚胺的反应得到64-70%的产率,但邻二甲苯的产率为18%,这表明空间位阻减缓了反应速率。对氯甲苯和乙苯也提供了34-40%的预期产品产率。当对二甲苯与Me取代的N-酰基琥珀酰亚胺偶联时,获得了良好的收率。
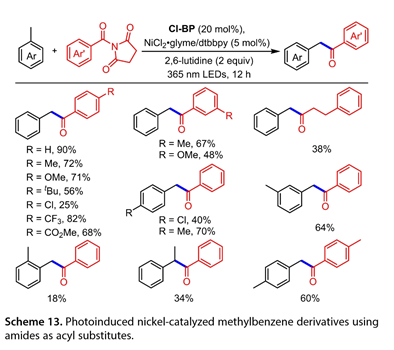
图13. 以酰胺为酰基取代基的光诱导镍催化的甲苯衍生物
当甲苯和Cl-BP的混合物被365 nm LED照射12小时(图14)时,观察到1,2-二苯基乙烷,表明形成了[Cl-BP-H]*。添加自由基清除剂2,2,6,6-四甲基-1-哌啶-氧基(TEMPO)可以有效地抑制这种反应。这些结果表明,该光催化反应中产生了苄基自由基。图15概述了可能的机制。用20W 365 nm LED 照射Cl-BP得到激发的Cl-BP(Cl-BP*),它可以从甲苯中提取氢以得到[Cl-BP-H]*和苄基自由基(24)。同时,N-酰基琥珀酰亚胺衍生物(25)氧化加成LnNi0(26)生成中间体(27)。随后,(24)与(27)结合以递送NiIII (28)。还原消除得到所需的芳香族酮和(29),随后通过[Cl-BP-H]*还原得到Cl-BP和(26),从而完成该催化循环。
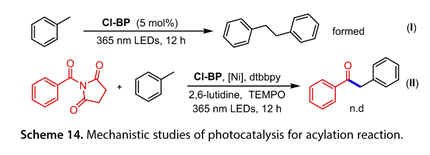
图14. 光催化酰化反应的机理研究
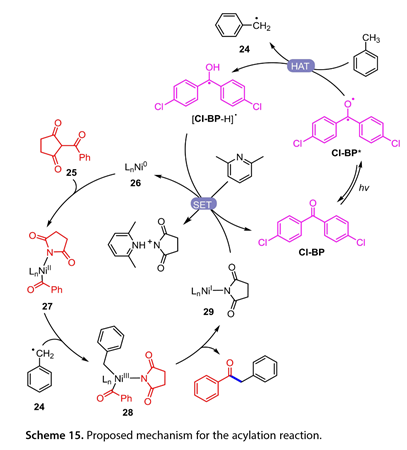
图15. 推测的酰化反应机理
3. 苄基C-H的三氟甲基化
2022年,Liu及其同事报告了通过光氧化还原和不对称铜催化组合的苄基C-H键的首次对映选择性自由基三氟甲基化(图16)。在395 nm LED 的照射下,使用 Cu(MeCN)4PF6(15 mol%)、L1(18 mol%)、2-氯蒽-9,10-二酮(Cl-AQ,10mol%)和并四苯- 5,12 -二酮(TD,4mol%)在 CHCl3中成功进行了一系列对映选择性苄基C-H三氟甲基化。在3位或4位的乙苯取代基以58–78% 的产率和出色的对映选择性 (82–94% ee)得到产物。此外,烷基碳链上的一系列官能团,如卤素、酯、酰胺和砜,耐受率为48-77%,ee为85-91%。杂芳烃,包括苯并[d]噻唑和苯并[d]恶唑,成功地与Togni-II偶联,提供了53-62%的产率和92%ee的所需产物。使用这种双重催化体系进行区域选择性C-H三氟甲基化反应提供了合理的产率(41-61%)和出色的对映选择性(88-94% ee)。
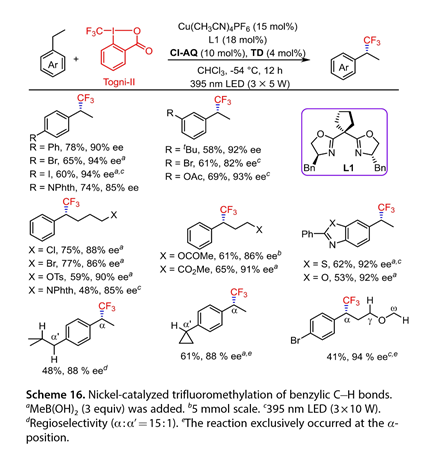
图16. 加入镍催化苄基碳氢键三氟甲基化反应
Stern-Volmer荧光猝灭实验表明,该衬底可以有效猝灭光催化剂的激发态。动力学同位素效应测量表明,该反应的速率决定步骤是HAT过程。降低反应温度提高了反应收率和对映选择性。该结果证明差异焓有助于对映决定步骤。如图17所示,AQ最初由395 nm LED激发,以产生激发的AQ(AQ*)。然后,自由基AQ*可以从乙苯的苄基位置提取氢,提供苄基自由基(30)和[AQ-H]*。同时,将L*Cu(I)(31)被Togni-II试剂氧化得到L*(OBz')Cu(III)CF3(32),经[AQ-H]*还原,得到L*Cu(II) CF3(33),AQ再生。最后,L*Cu(II)CF3物种可以捕获30,导致目标产物的形成,从而完成催化循环。
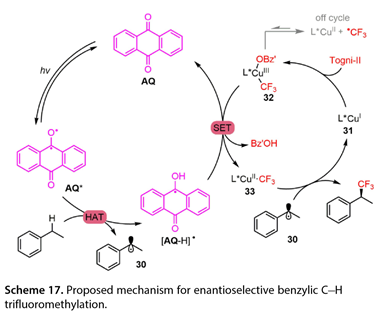
图17.对映选择性苄位C-H三氟甲基化反应机理
4.环合反应
2022年,Gong及其同事报告了一种光催化非对映和对映选择性分子内环化反应的方法(图18)。455 nm LED、5,7,12,14-戊烯醚酮(PT)(5mol%)、L2(11mol%)、NiBr2(10 mol%)、Na2CO3(1.5eq)在CHCl3中照射。有效地促进了这种立体选择性C(sp3)功能化/环化级联反应。在苯基环的对位带有吸电子基团或供电子基团的(3-氯丙基)-苯转化为所需的手性多环苯并磺胺(42-82%产率,高达>20:1dr,52-98% ee)。用N-磺酰胺处理2-(3-氯丙基)-噻吩也导致多环产物的形成。然而,这种光催化反应不适用于仲氯化物和叔氯化物。在优化条件下耐受各种N-磺酰亚胺,产量不适中,ee为80-92%,最高可达20:1dr。
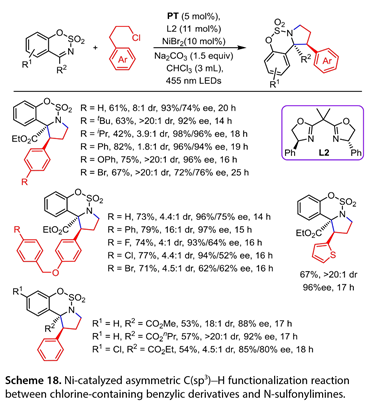
图18. Ni催化含氯苄基衍生物与N -磺酰亚胺的不对称C ( sp3 ) H官能化反应
在优化的反应条件下,1-(氯甲基)-2-甲基苯、2(氯甲基)-1,3-二甲基苯和4-溴-1(氯甲基)-2-甲基苯与N-磺酰亚胺反应,得到的相应产物收率51–68%,ee为76–91%。具有两个邻近立体中心的手性稠合四氢异喹啉的产率为64–76%,ee为91–99%(图19)。
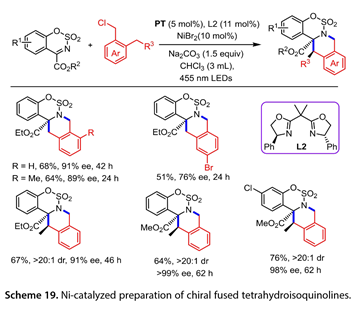
图19. Ni催化的手性四氢异喹啉类化合物的制备
该反应的拟议机理如图20所示。PT通过辐照激发产生激发物种PT*。PT*提取(3氯丙基)-苯的苄基C-H键得到C中心自由基(34)和[PT-H]*,进而还原镍配位的N-磺酰亚胺(36)生成中间体(37)和光催化剂(PT)。中间体38由34加入到37形成,然后分子内亲核攻击得到39。随后,中间体39和35之间的配体交换产生目标产物和中间体36,从而完成催化循环。
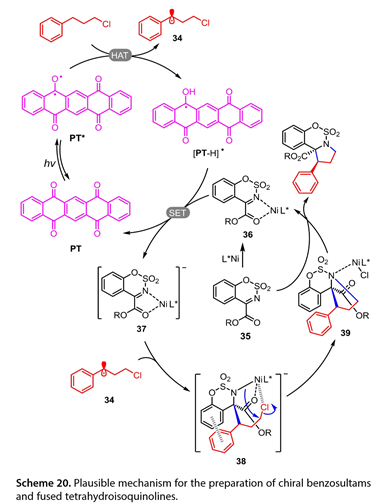
图20. 可能的机理用于制备手性苯并磺内酰胺和四氢异喹啉类化合物
5.芳基卤化物的炔化反应
2020年,Liand及其同事[21]利用噻噻烷-9-酮(TXO)作为光敏剂,在45W CFL的照射下,以无水Zn(OTf)2为添加剂,有效地加速了炔烃的芳基化反应(图21)。含缺电子基团和富电子基团的芳基炔烃成功地偶联到4-溴苯腈上,产率良好至中等(产率为68-93%)。2-乙炔基萘参与了这一转化,收率为62%。4-乙炔基吡啶也可用作底物,得到相应产物的收率为55%。烷基炔烃反应平稳,使芳基化产物收率差至极好。与乙酮反应产生所需产品收率45%。1-乙炔基-4甲基苯与苯基环上不同官能团的芳基溴芳基化反应进展顺利,收率达到49–89%。发现杂芳基溴是有效的偶联伙伴(产率为72%)。然而,当使用5-溴苯并[d][1,3]-二恶茂时,没有观察到所需的产物。相比之下,5-碘苯并-[d][1,3]二恶确实反应了62%的产率。
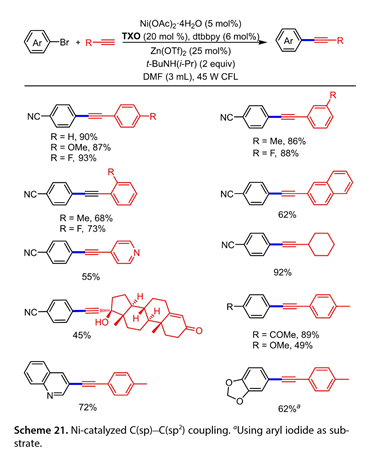
图21. Ni催化的C(sp) C(sp2)偶联反应。以芳基碘化物为底物
如表1所示,目标产物的产率与光催化剂的三重态能(ET)密切相关,而不是与激发态氧化电位密切相关,并且具有最高ET的TXO被证明是最有效的。用1-乙炔基-4-甲基苯处理(dtbbpy)-4-氰基苯基溴化镍(Ni-1),在45W CFL和紫外光的照射下,分别得到13%和24%的预期产物产率(图22)。4-溴苯腈和1-乙炔基-4-甲基苯在45W CFL或者在365 nm下交叉偶联得到11%或16%的产物收率。这些结果表明,光催化剂激发态与NiII中间体之间的三重态-三重态能量转移参与了该反应。
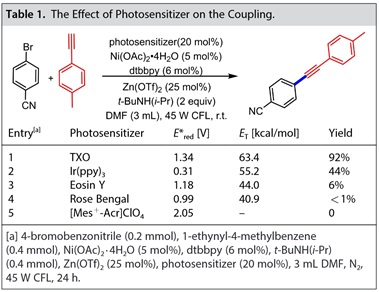
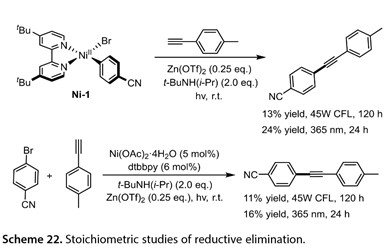
图22. 还原消除的化学计量学研究
非机理研究揭示了退出状态光催化剂与Ni(II)之间的初始能量转移(图23)。芳基卤化物的氧化加成[(dtbbpy)Ni0](41)得到(dtbbpy)NiII(Ar)X(42)。(42)与原位形成的乙酰炔锌(40)的金属转染生成芳基-Ni(II)乙酰基(43)。同时,用光照射将TXO转换为光激发TXO(TXO*),然后将能量转移到(43)。得到的(44),经过还原消除,得到目标产物,从而完成催化循环。
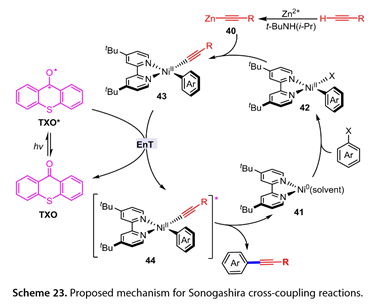
图23. 提出的Sonogashira交叉偶联反应机理
6.芳基卤化物的醚化
一些研究人员报道了在可见光下使用TXO作为光敏剂对酚和芳基卤化物进行镍催化醚化(图24)[22]。一系列的机理实验表明,涉及从TXO(TXO*)激发态到NiII复合物的三重态能量转移的过程可能是可操作的。邻位、间位或对位取代的溴苯与苯酚高效偶联,使联芳基醚的产率为60-91%。当使用2-溴萘时,以51%的收率获得所需的产物。杂芳基溴提供了相应的产品,收率为94%。观察到在酚的3或4位存在富电子或电子中性基团有利于这种光催化反应。然而,贫电子酚需要延长120 h的反应时间,收率达到51-53%。同样,邻位取代的酚提供了所需的产物,但需要更长的120小时照射时间。值得注意的是,氯代芳烃,1 - ( 4 -氯苯基)-乙酮,也能以28 %的产率得到。

图24. Ni催化苯酚的O -芳基化反应。以氯代芳烃为底物
7.酚类酯化反应
2022年,Li和合作者[23]报道了一种通过Ni催化的苯酚与芳香醛的无受体脱氢酰基化反应合成苯甲酸芳酯的新方法( 图 25 )。值得注意的是,这种光催化反应不需要外部光催化剂,因为醛执行了这种作用。在NiCl2 glyme ( 10mol %),dtbbpy ( 12mol %),Na2CO3 ( 1equiv )存在下,以二氯乙烷( DCE , 1mL)为溶剂,365 nm LEDs下反应24h,成功实现了醛与酚的偶联。值得注意的是,戊醛与保护的α -氨基在20mol %的苯甲醛催化下,以70 %的产率得到了偶联产物。雌酮是该光催化反应的良好底物,在最优条件下,偶联产物的产率为85 %。
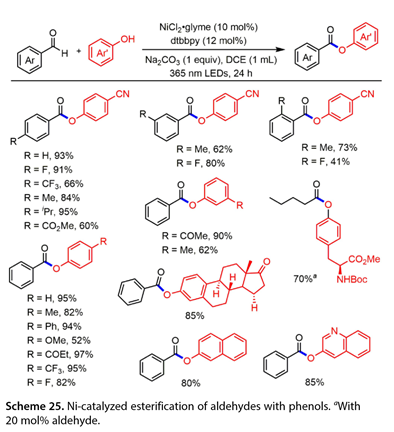
图25. 镍催化的醛与酚的酯化反应
荧光猝灭实验表明苯甲醛( BD * )的激发态与苯酚或酚酸盐之间存在一个SET过程。在优化的反应条件下,加入1,1 -二苯基乙烯或2,6 -二叔丁基- 4 -甲基苯酚作为自由基捕获剂,分别得到了2 %和15 %的目标产物,表明酰基自由基的存在生成。高分辨质谱( HRMS )表明苯氧基、羟苯基和苯甲酰基的产生。在(图26)中概述了醛与酚酯化反应的可能机理。用365 nm的LED照射BD,得到激发的BD *。芳氧自由基( Ar ' O * , 45)可以通过酚酸盐阴离子或苯酚与BD *之间的SET或HAT得到。BD *还可以从苯甲醛中夺取一个氢原子,得到一个苯甲酰基自由基( ArCO *、46 )和BD *。中间体(45)和(46)可与LnNiⅠ- X ( 47 )反应生成LnNiⅢ( Ar ' O) ( ArCO ) X ( 48 ),然后经过还原消除生成目标产物和(47)。生成的NiI络合物再与Ar ' OH或H+反应,得到Ni ( II )中间体( 49 )和H2。最后用BD·-对(49)进行消除,重新生成BD和(47).
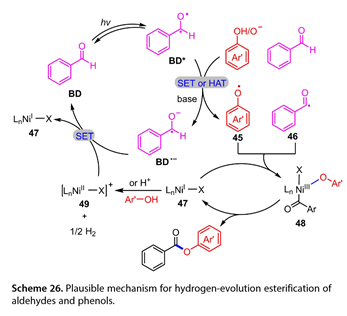
图26. 醛、酚类化合物可能的析氢酯化反应机理
8.硼化
在2023年,Takaya和他的合作者[24]报道了通过光能和Rh催化的组合来实现芳基酮的C-C σ -键的硼化来合成芳基硼酸酯(图27)。一系列苯环对位带有给电子或吸电子基团的特戊烯酮以良好的产率得到了所需的芳基硼酸酯。然而,4 - Ph取代的特戊烯酮并不是该反应的合适底物。间位和邻位取代的苯乙酮也被硼化,以56 ~ 81 %的收率得到预期产物。含缩酮结构的底物与HBpin反应得到了目标产物。此外,羰基碳上的一系列烷基也被接受( 16-48 %的产率)。自由基捕获剂实验表明,该反应涉及苯甲酰基自由基中间体。用DBpin代替HBpin进行氘标记实验表明,氘转移到产物异丁烷的次甲基碳上。基于这些结果,提出了一种可能的机制(图28 )。在365 nm光照下,PIP可通过C-C σ -键的σ -断裂产生芳酰基自由基( 50 )和叔丁基自由基( 51 )。(51)和HBpin之间的HAT导致异丁烷( 53 )和硼基自由基的形成。随后,(50)与硼自由基被铑配合物( 52 )捕获,得到芳酰基(硼基)铑配合物( 54 ),该配合物挤压CO生成芳基(硼基)铑配合物( 55 )。最后,还原消除(55)得到硼化产物同时再生铑配合物(52),从而完成催化循环。
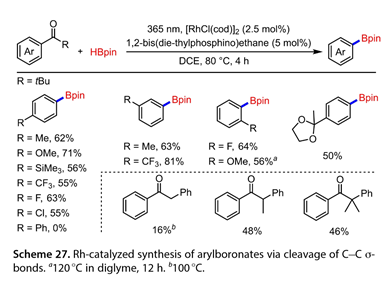
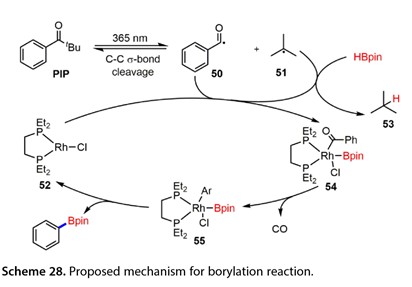
图27和28. Rh催化C-C σ键断裂合成芳基硼酸酯过程机理
9 .磺化
2021年,Gong及其合作者报道了环烷烃、烷烃、甲苯衍生物和醚的直接和选择性不对称磺酰化反应的有效方法(图29 )[25]。在24W 455 nm LED照射下,以二氯乙烷为溶剂,以5,7,12,14 -五乙酰苯乙酮( PT )、L3( 18mol %)、Ni( ClO4 )2·6H2O ( 15mol %)为原料,对一系列未取代的环烷烃与1,4 -二氮杂双环[ 2.2.2 ]辛烷1,4 -二鎓- 1,4 -二亚磺酸盐( DABCO·( SO2 ))2和含N-酰基吡唑的α,β -不饱和羰基化合物进行磺酰化反应,以优异的化学选择性( 91 ~ 95 % ee)得到62 ~ 73 %的收率。均三甲苯工作良好,得到相应的手性产物( 72 %收率, 90 % ee)。二级苄基烃与( DABCO·( SO2 ))2和N-酰基吡唑的反应获得了中等收率。2 -甲基噻吩以60 %的收率得到目标产物,ee值为88 %。含有β -芳基的α,β -不饱和N-酰基吡唑也能以60 %的收率得到,83 %的ee值。
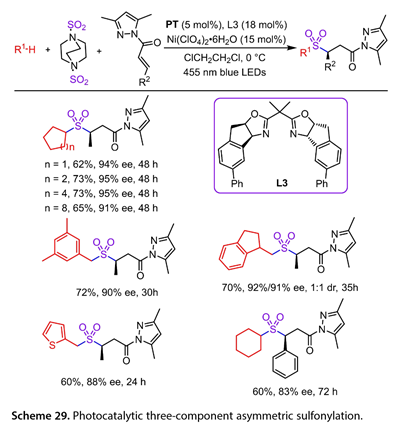
图29. 光催化三组分不对称磺酰化反应
TEMPO的存在完全抑制了该反应,并通过HRMS观察到TEMPO-C自由基产物(图30)。4 - (环丙基甲基) – 1,1 ' -联苯反应以63 %的产率得到开环产物。此外,PT的激发态被甲苯猝灭。这些观察与苄基自由基的形成是一致的。环丙基取代的N-酰基吡唑没有得到开环产物,说明N-酰基吡唑的β -碳自由基不是中间体。同样,用N-酰基吡唑处理环戊烷亚磺酸钠也没有得到预期的产物,排除了磺酰负离子中间体的形成。
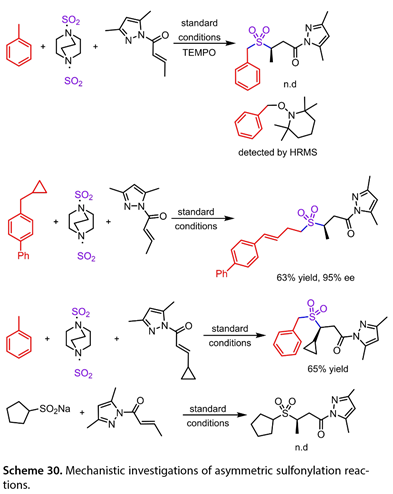
图30. 不对称磺酰化反应的机理研究
反应机理如式( 31 )所示。首先,在455 nm LEDs的照射下,PT被激发到三重态( PT * ),它可以从R1-H中提取一个氢原子,生成[ PT-H ] *和碳自由基中间体( 56 )。然后,二氧化硫释放原位空穴(56),以容纳磺酰基自由基( R1SO2 * ) ( 57 )。同时,α,β -不饱和N-酰基吡唑( 61 )与L * Ni进行配体交换得到Ni配合物( 58 ),配合物( 58 )可与(57)反应得到中间体(59)。(59)和[ PT-H ] *之间的单电子转移可以产生PT和中间体(60)。随后在中间体(60)和(61)之间进行配体交换,得到所需的手性砜,完成光催化循环。
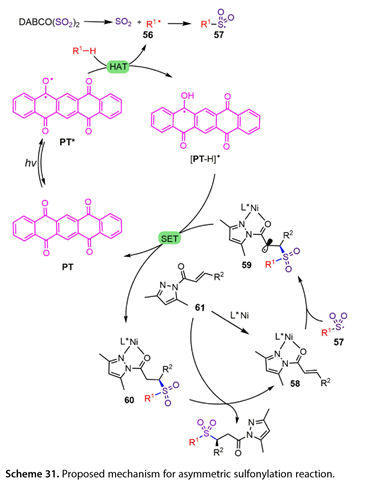
图31. 提出了不对称磺酰化反应的机理
最近,Gong等报道了在PT存在下,甲苯衍生物和环烷烃与亚磺酸钠发生位点选择性C(sp3)-H磺酰化反应的温和方法( 10 mol % )和Cu (OTf)2 (1.2 equiv),在50 W 410 nm LED照射下(图32)。富电子的乙苯可以有效的偶联,以良好的产率( 64-74 % )得到目标产物。含有顺式侧链或远程官能团的次级苄基碳氢键底物也能有70 - 78 %的产率。含有二级和三级C-H键的1 -乙基- 4 - ( 4 -异丙基苯氧基)苯与苯亚磺酸钠反应以48 %的收率得到目标产物,位点选择性为2:1rr。在苯环对位带有吸电子或供电子基团的芳基磺酸盐与交叉偶联是相容的。噻吩- 2 -亚磺酸钠或萘- 2 -亚磺酸钠经此偶联反应,以71 - 75 %的收率得到目标产物。值得注意的是,烷基亚磺酸钠适合于这种转化,并且在最佳反应条件下获得了良好的产率。此外,其他C(sp3)-H前体,如环烷烃、金刚烷与4 -溴苯亚磺酸钠的磺酰化反应也能以中等的产率得到目标产物。
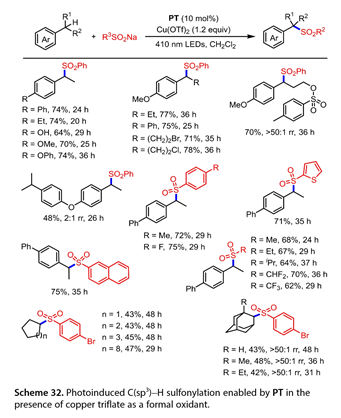
图32. 在三氟甲磺酸铜作为氧化剂通过PT实现了光诱导的C(sp3)-H磺酰化反应
机理研究表明,激发态的PT ( PT * )可以从C(sp3)-H前体中抽提H原子,得到以C为中心的自由基( 62 )和[ PT-H ] * (图33 )。同时,Cu ( OTf )2( 63 )与R4SO2Na反应生成[ TfO - CuⅡ- SO2R4] ( 64 ),[ TfO - CuⅡ- SO2R4] ( 64 )捕获62得到Cu ( III ) ( 65 )。该65再经过还原消除,生成目标产物和CuIOTf。最后,CuⅠ中间体歧化生成Cu0和CuⅡ。后者再被[ PT-H ] *还原生成CuI和PT,从而完成催化循环。
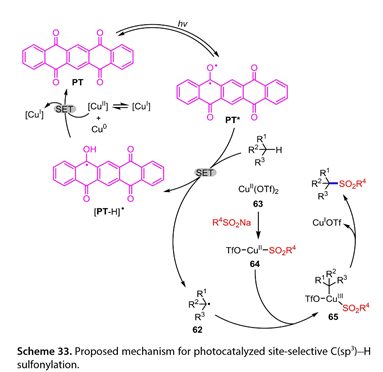
图33. 提出了光催化反应位点选择性C(sp3)-H磺酰化的机理
2022年,Li课题组报道了在dtbbpy ( 12 mol % )、DMSO ( 3 m L )存在下,以2 -氯-硫代氧杂蒽- 9 -酮( Cl-TXO )为光催化剂,镍催化芳基亚磺酸盐与(杂)芳基卤化物的交叉偶联反应(图34)。文献报道了苯亚磺酸钠与一系列苯环4位、3位、5位带有吸电子或供电子基团的芳基溴化物的交叉偶联反应,得到了目标产物(收率35 % ~ 90 %)。邻位取代的芳基溴化物以47 % ~ 53 %的收率得到交叉偶联产物。2溴代萘与杂环芳基溴化物反应,以中等收率得到磺酰化产物( 50 ~ 88 % )。产量)。以55 - 83 %的收率分离了F、Me、CF3取代的芳基磺酸钠。萘- 2亚磺酸酯的芳基化反应以60 %的收率得到相应的产物,杂环磺酸钠与4 -溴苯腈反应以50 %的收率得到相应的二芳基砜。
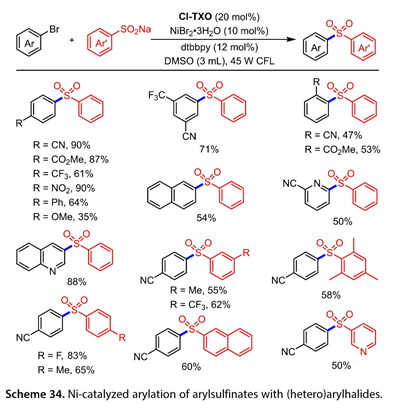
图34. Ni催化芳基亚磺酸酯与(杂)芳基卤化物的芳基化反应
如图 35所示,预期产物的产率与光催化剂的激发态氧化还原电位有关,还原电位最高的Cl-TXO是最有效的,表明SET介于光催化剂和镍催化循环之间。此外,1,1 -二苯基乙烯或TEMPO的加入导致产率降低,表明该反应有自由基物种参与。
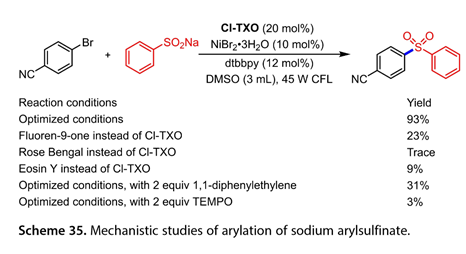
图35. 芳基亚磺酸钠芳基化反应的机理研究
Cl-TXO的激发态( Cl-TXO * )可以氧化Ar ' SO2Na得到[ Cl-TXO ] *和芳基磺酰基自由基( Ar ' SO2 *) ( 66 ) (图式36 )。随后,Ar-X与Ln Ni0(溶剂) ( 67 )氧化加成生成的Ln NiII ( Ar ) X ( 68 )捕获(66)得到NiIII中间体( 69 )。中间体(69)经过还原消除得到所需的二芳基砜和LnNiI - X ( 70 )。最后,(70)氧化[ Cl-TXO ] *完成催化循环。
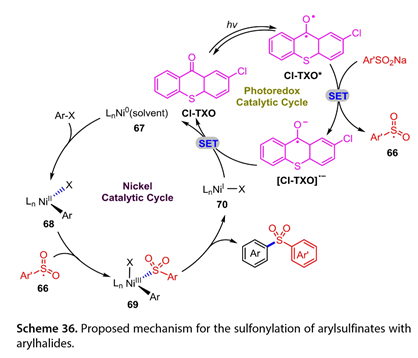
图36. 提出了芳基亚磺酸盐与芳基卤化物的磺酰化反应机理
10 .芳基卤化物的磷酸化
2021年,Li和同事报道了在45 W CFL辐照下,通过硫代氧杂蒽- 9 -酮( TXO )和镍催化剂的组合构建芳基氧膦和芳基磷酸酯,用于H -氧膦和H -亚磷酸酯与芳基卤化物的芳基化反应(图37 )[28]。缺电子的溴代芳烃以中等到良好的产率发生偶联反应,而富电子的溴代芳烃不发生反应。1 - Iodo - 4-甲基苯酚以66 %的收率得到预期产物。3溴喹啉同样以67 %的收率得到相应的产物。一些H -膦氧化物和H -亚磷酸酯底物,如二对甲苯基氧化膦、二烷基亚磷酸酯和二苯并[ c、e][ 1、2 ]氧杂膦- 6 -氧化物,都能以较好的产率得到芳基化产物。
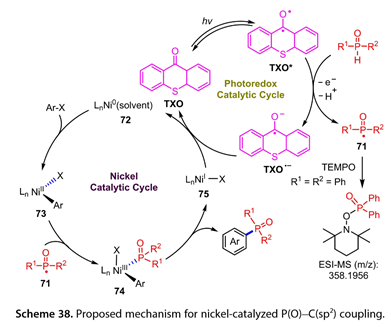
图37. Ni催化的芳基卤化物的光诱导膦酰化反应
产物的产率与光催化剂的激发态氧化还原电位有很强的相关性。此外,在这种光诱导膦酰化反应中产生了以磷为中心的自由基,通过电喷雾电离质谱和自由基捕获实验进行了表征。如图38所示,激发态的TXO ( TXO* )与[ R1R2P ( O )H ]之间的SET或HAT过程生成[ TXO ]*和[ R1R2P (O)* ] ( 71 ),然后参与镍催化的芳基溴化物的膦酰化反应,包括Ar-X与Ln Ni0的氧化加成( 72 ),71与Ln NiII ( Ar ) X的加成( 73 ),以及Ln NiIII ( Ar ) ( POR1R2 ) X的还原消除( 74 ),得到目标产物和Ln NiIX ( 75 )。
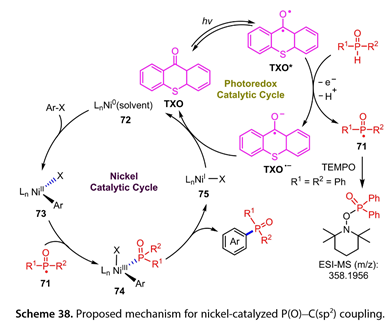
图38. 提出了镍催化P(O)-C(sp2)偶联的机理
11.三组分烯烃偶联
Wang课题组在温和条件下发现了一种钯催化的烯丙基烷基化反应,该反应涉及一种HAT光催化剂介导的亲核试剂生成策略(图39)。多种末端烯烃,脂肪族C ( sp3 ) H偶联伙伴以5,7,12,14 -五苯乙酮( PT ) aHAT为光催化剂,Pd2 ( dba ) 3 / P( 3 , 5 - Me2C6H3)3为催化剂,DCE为溶剂,在6W 420 nm LEDs的照射下,烯丙基碳酸酯适合于该三组分偶联反应。苯环上带有给电子或吸电子取代基的末端烯烃均能以56 - 83 %的产率得到所需的烯丙基化产物。在该烯丙基烷基化反应中也引入了2 - (吡啶- 3 -基)丙烯酸甲酯,发现α -烷基丙烯酸酯是有效的,以51 - 54 %的收率得到交叉偶联产物。同样,烯丙酰苯也得到了目标产物( 50 %收率)。2,3 -二甲基丁烷在第3位进行官能化。吸电子基、富电子基或电子中性基取代的甲苯产品收率48 - 81 %。2 -甲基噻吩也是一个合适的底物,以42 %的产率得到了预期的产物。环己基苯的苄位选择性C-H官能化反应以45 %的产率得到了预期的产物。1,3 -苯并二氧杂环戊烷以优异的收率( 84 % )反应。值得注意的是,一些取代的烯丙基碳酸酯,包括2 -烷基和2 -芳基取代的烯丙基碳酸酯也以61 - 80 %的产率得到了相应的产物。
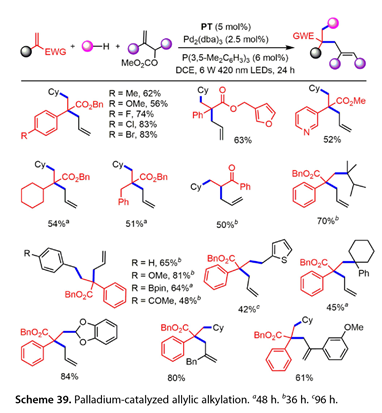
图39. 钯催化烯丙基烷基化反应a48h . b36h . c96h .
在模型反应中加入TEMPO有效地阻止了烯丙基烷基化反应的进行,并通过HRMS检测到了烷基- TEMPO加合物(图40 )。Stern – Volmer淬灭实验表明,环己烷或甲苯降低了PT的光致发光强度。这些结果表明,激发态的PT将H原子从C H耦合伙伴中提取出来。此外,在Pd2 ( dba )3和P(3,5 - Me2C6H3)3存在下,Giese加成产物和甲基烯丙基碳酸酯的处理并没有得到所需的烯丙基化产物,表明光催化Pd催化的烯丙基烷基化反应并没有发生。质子转移穿梭体六氟异丙醇( HFIP , 60mol %)的存在完全抑制了反应的进行,表明该反应涉及质子转移。
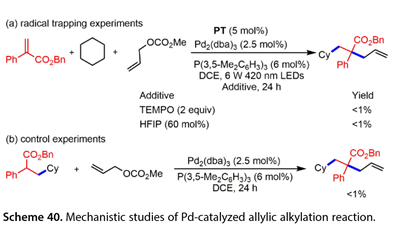
图40. 钯催化烯丙基烷基化反应的机理研究
在图41中,我们提出了一种双光氧化还原/钯催化机制。激发态PT ( PT * )和环己烷之间的HAT导致烷基自由基( 76 )和[ PT-H ] *的形成。前者迅速被贫电子烯烃捕获,生成缺电子自由基( 77 ),该自由基被[ PT-H ] *氧化生成碳负离子亲核试剂( 78 ),PT再生。Pd0( 79 )与烯丙基碳酸酯配位,形成π -烯丙基中间体( 80 )。然后,Pd -配合物(80)失去碳酸二甲酯,得到阳离子型Pd (Ⅱ) π -烯丙基配合物( 81 )。该物种随后受到(78)的攻击,产生所需的产物,再生(79)。
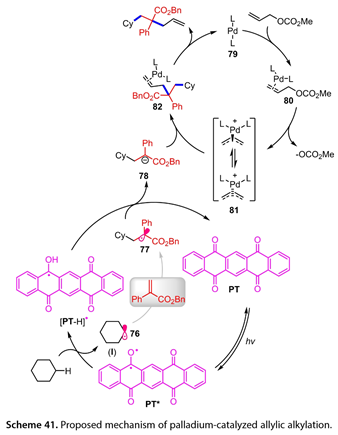
图41. 提出了钯催化烯丙基烷基化反应机理
2021年,莫兰德及其合作者报道了镍催化的以醚或醇为自由基前体,4 - ( 4 -甲氧基苯甲酰基)苯甲腈(CN-Ome-BP)为催化剂的烯烃多组分双碳官能化反应(图42)。Zhang等用含吸电子基团的芳基溴化物处理环戊基甲醚,得到了较好的交叉偶联产物。电子中性或供电子的芳基溴化物不是合适的底物,但芳基碘化物具有足够的反应活性。氟马西尼被转换为以36 %的收率得到目标产物。5 -溴- 2 - (三氟甲基)吡啶以65 %的收率得到相应的目标产物。醇和α -硼酸酯底物参与了该转化,得到了目标产物(收率35 ~ 91 %)。此外,一系列内烯烃以34-80 %的收率和良好的非对映选择性反应。
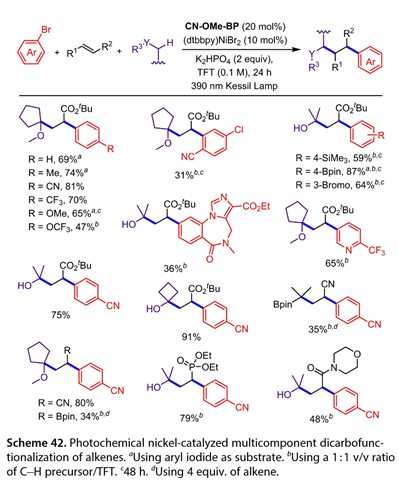
图42. 光化学镍催化烯烃多组分双碳官能化反应
图43概述了三组分HAT介导的光氧化还原/镍双催化烯烃双碳官能化的机理。激发态的CN-Ome-BP ( CN-Ome-BP *)可以从C-H底物中抽提H原子得到[ CN-OMe-BP-H] *和碳中心自由基( 83 ),然后与活化的烯烃发生Giese加成,得到相应的自由基加合物( 84 )。同时,Ar-Br与Ni ( 0 )( 85 )发生氧化加成反应,生成Ni ( II )中间体( 86 ),后者捕获(84)生成Ni ( III )配合物( 87 )。接着,(87)的还原消除得到目标产物和Ni ( I )配合物( 88 )。最后,(88)和[ CN-OMe-BP-H] *之间的SET再生CN-OMe-BP和产物(85),完成两个催化循环。
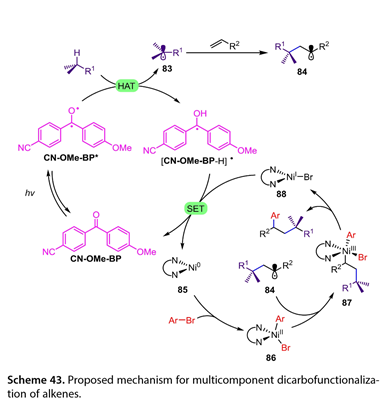
图43. 提出了烯烃多组分双碳官能化的机理
2022年,Noël小组[31]报道了近紫外光诱导Ni催化的二苯甲酮类光催化剂和硅烷参与的烯烃的交叉亲电偶联和1,2 -二碳官能化反应( 图 44 )。在( 4-甲氧基苯基) ( 4- (三氟甲基) phenyl )甲酮(CF3-OME-BP),( dtbbpy ) Ni Br2,2,6-二甲基吡啶,( TMS ) 3Si H存在下,伯、仲烷基溴与对溴苯甲酸甲酯高效偶联,在16 W 365 nm连续流动光照射下,以55 - 90 %的产率得到相应的产物。二级杂环烷基溴化物具有良好的耐受性,以50-76 %的产率得到芳基化产物。雄酮以60 %的收率得到目标产物。利用该光致发光器件将不同范围的(杂)芳基溴化物与溴丙基硼酸频哪醇偶合如5 -溴- 2 - (三氟甲基)吡啶、5 -溴苯并[ b ]噻吩、5 -溴- 1 -甲基- 1H -吲哚、2 -溴二苯并[ b、d]呋喃等,也有使用这种连续流动协议(收率56 ~ 76 %)对交叉耦合产品进行了研究。以Ph CF3为溶剂,在390 nm下照射16 h进行烯烃的还原1,2 -双官能团化反应( 图 45 )。环己基溴化物、丙烯酸叔丁酯和芳基溴化物在对位和间位引入吸电子或供电子基团,反应收率为40 % ~ 63 %。杂芳烃5 -溴- 2 (三氟甲基)吡啶也能顺利反应,以45 %的产率得到目标产物。含氧和氮杂原子的杂环溴化物也被容忍,给出交叉偶联产物的产率在45 - 56 %。无环溴化物是该转化的适宜底物(产率65 % )。1,3 -二溴金刚烷以67 %的收率在单一位置被官能化。苯乙烯基硼酸频哪醇酯和呋喃- 2 ( 5H )均为较好的底物,产率分别为72 %和61 %。甾酮衍生物也是良好的底物。值得注意的是,4 -取代苯甲酰氯和丁酰氯也可用于(收率42 % ~ 65 %)。
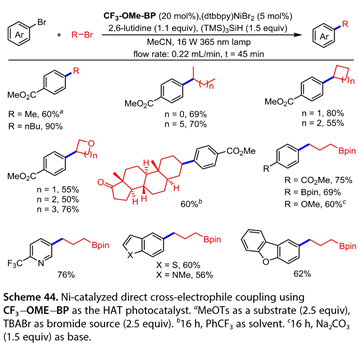
图44. 以CF3-OME-BP为HAT光催化剂,Ni催化的直接交叉亲电偶联反应
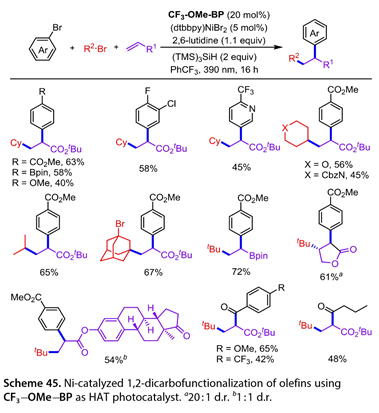
图45. 以CF3-OME-BP为HAT光催化剂,Ni催化烯烃的1,2 -双碳官能化反应
该还原交叉偶联的机理涉及激发态CF3-OME-BP从( TMS )3SiH中提取氢生成硅中心自由基( 89 )和酮基自由基[CF3-OME-BP-H] * ( 图46 )。卤素原子从溴代烷基转移到(89),形成( TMS )3SiBr和以碳原子为中心的自由基( 90 )。由Ar BrtoaNi ( 0 )物种( 91 )氧化加成生成的中间体(92)捕获(90),得到( dtbbpy ) NiⅢ( R ) ( Br ) ( Ar ) ( 93 ),经还原消除生成目标产物和Ni ( I )物种( 94 )。从[ CF3 OME BP H] *到(94)的SET给出了(91)和CF3-OME-BP。
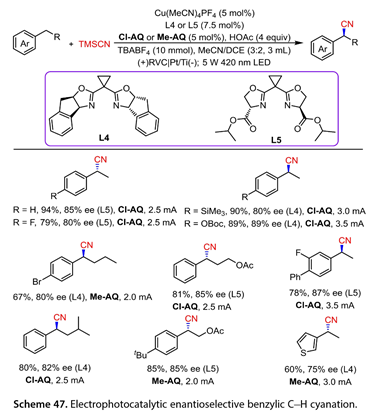
图46 提出的交叉亲电耦合机理
12.苄位C-H氰化
2022年,Liu课题组[32]报道了一种结合电光化学氧化和铜催化的高效的苄位C-H氰基化方法(图47)。优化的反应条件为:420 nm LEDs照射,Cu(MeCN)4PF4 ( 5mol % ),双恶唑啉( L4 / L5 , 7.5 mol %),2 -氯蒽醌( Cl-AQ )或2 -甲基蒽醌( Me-AQ ) ( 5mol % ),HOAc ( 4equiv ),TBABF4 ( 10 mmol )在MeCN / DCE中,以网状玻碳( RVC )为阳极,Pt / Ti为催化剂,恒电流条件下反应在未分裂的细胞中的阴极。该反应有效地促进了苄位C-H的不对称氰基化反应。对位被吸电子或富电子基团取代的乙苯类化合物与TMSCN高效地反应,以良好至高产率和良好的对映选择性得到目标产物。卤代正丁基苯以67 %的产率和80 %的ee值反应。含有OAc基团的底物以81 %的产率和85 %的ee值反应。异戊基苯和4 - (叔丁基)乙酸苯乙酯得到所需的手性产物(收率80 ~ 85 % , ee 82 ~ 85 %)。3 -乙基噻吩是这种不对称苄位C-H氰化反应的良好底物。
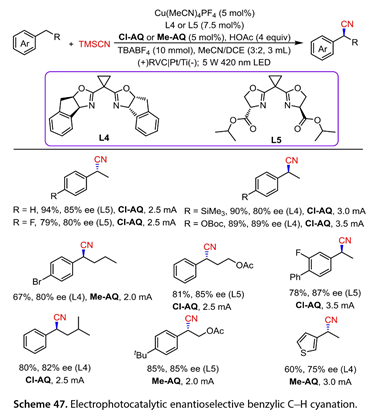
图47. 电光催化对映选择性苄位C-H氰化反应
激发态的R-AQ从乙苯中抽提一个氢原子,得到苄基自由基( 95 )和[R-AQ-H] * (图 48 )。然后,L * Cu ( II ) ( CN )2 ( 97 )与(95)结合,得到目标分子和L * Cu ( I ) ( CN ) ( 96 )。[ R-AQ-H]*和(96)被阳极氧化,并伴随着H2的析出完成催化循环。
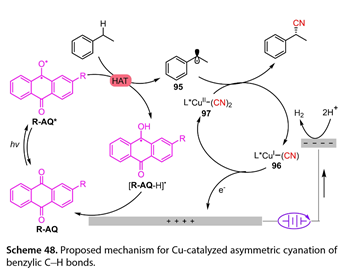
图48. 提出了Cu催化苄位C氢键不对称氰基化反应的机理
同年,Xu和合作者发展了一种无氧化剂的光电催化苄位C(sp3)-H不对称氰基化制备手性苄腈的方法。这些作者提出了不同的机制( 图 49 )。烷基芳烃可以向激发态光催化剂蒽醌- 2,7 -二磺酸钠( AQDS * )转移一个电子,产生离子-自由基对,该自由基对发生质子转移,生成苄基自由基( 98 )和[ AQDS H ] *。然后,这个自由基( 98 )被L * Cu ( II ) ( CN ) 2 ( 99 )截获,得到一个Cu ( III )物种( 100 ),它经过简单的还原消除生成所需的手性苄腈和L * Cu ( I ) ( CN ) ( 101 )。最后,[ AQDS H ] *和(101)在阳极被氧化得到AQDS和(99)。
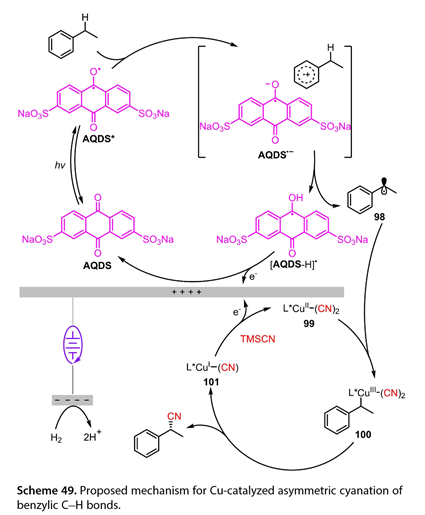
图49. 提出了Cu催化苄基碳氢键不对称氰化的机理
395 nm LEDs照射和同时电解的条件下,一系列官能化的烷基苯以较好的产率和较高的位点和对映选择性发生反应( 图 50 )。含有溴代物、磺酸盐、环氧化合物、硅醚、酯、羧酸、烷基叠氮和氨基酯的乙苯进行苄位C(sp3)-H氰基化反应,产率为44 - 86 %。电子中性、富电子和缺电子的对位或间位取代的乙苯也产生了所需的产物( 51 ~ 84 %收率, 84 ~ 94 % ee)。5 -乙基- 2 -甲基吡啶与TMSCN的交叉偶联反应以60 %的收率得到氰基化产物,ee值为81 %。具有多个潜在位点的底物以良好的产率和较高的位点选择性和对映选择性进行反应。较大的站点电子密度和较低的空间位阻是选择性氰基化的首选。
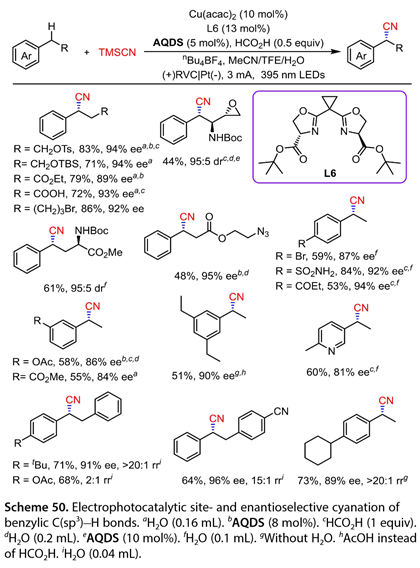
图50. 苄基C(sp3)-H的电光催化位点和对映选择性氰化
13.C(sp3)-H叠氮化
2020年,Lei课题组[34]报道了在电光催化条件下,以亲核试剂NaN3为叠氮源,锰催化C(sp3)-H的氧化叠氮化反应(图51)。在乙腈/乙酸混合溶剂中,1,10 -邻菲罗啉(邻菲罗啉, 20mol %),9 -芴酮( FLN为11mol %)或2,3 -二氯- 5,6 -二氰基对苯醌( DDQ , 5.5mol %),MnF2或MnBr2·4H2O ( 10 mol % ),KBr ( 40 mol % ),TFA ( 4.0 equiv )和LiClO4 ( 2.0 equiv )存在下,通过恒电流电解,在蓝光LEDs照射下,可以容忍一系列苄基C(sp3)-H。三级苄基C(sp3)-H以良好的产率提供了预期的叠氮化产物。含有两个三级苄基C(sp3)-H基团的1,4 -二异丙基苯可以以57 %的收率被使用,但得到了一些二叠氮化产物。乙苯衍生物与Na N3反应,以中等收率得到目标产物。一些含有简单C(sp3)-H的未活化底物也能以31 - 50 %的产率得到C(sp3)-H叠氮化产物。在图52中展示了这种C(sp3)-H的电光催化叠氮化的可能机理。在蓝光LED的照射下,羰基可以达到其激发态,从而将一个氢原子从基底上抽离出来给出了C(sp3)自由基( 102 )和酮基自由基。后者在阳极被氧化以达到其基态。同时,NaN3将一个电子转移到阳极,导致叠氮自由基的形成。随后,叠氮自由基从底物中抽提H原子得到HN3和(102)。阳极与Mn (Ⅱ) ( N3 ) / L ( 104 )的SET反应得到Mn (Ⅲ) ( N3 ) / L ( 105 ),(102)与(105)反应得到预期产物和Mn (Ⅱ) / L ( 103 )。
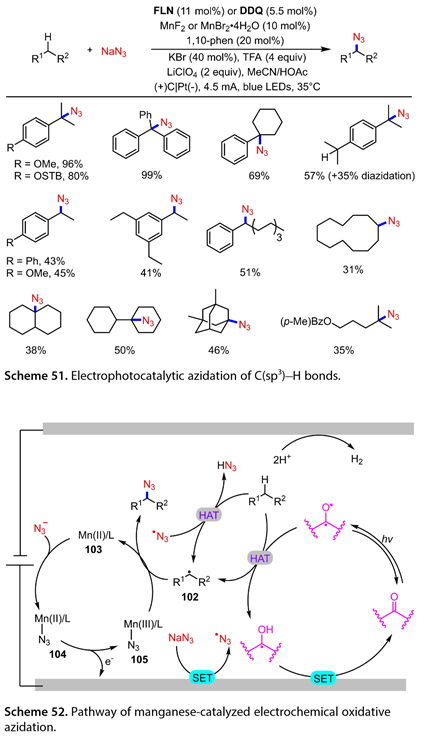
图51和52. C(sp3)-H的电光催化叠氮化反应过程和机理
14.脂肪族的脱氢
Huang和他的合作者[35]报道了钴催化的脂肪族底物的无受体脱氢反应( 图 53 ),在DCE中使用2 -氯蒽- 9,10 -二酮( Cl-AQ , 25mol %)和dmgH2 ( 50 mol % )在400 - 415 nm的LED照射下进行。各种取代的乙苯是合适的底物,提供了71 - 95 %的预期脱氢产物的产率。2 -萘乙烷是可行的该反应的底物。四氢萘和环己基苯以32 - 67 %的收率转化为萘和1,1'-联苯。3 -苯甲酸苯丙酯反应,收率59 % ( E / Z = 1∶1)。硫醚,如乙基(萘- 2基)硫烷和2 - (苯乙硫基)嘧啶,顺利地进行了脱氢反应(收率68 ~ 71 %)。N-芳基酰胺的反应以45 - 90 %的产率生成目标产物。有趣的是,α,β,γ,δ -不饱和内酰胺发生双脱氢反应得到1 -苯基氮杂环庚- 2 -酮。使用1,2,3,4 -四氢萘- 2 -醇或4 -苯基环己- 1 -醇得到了目标产物(收率61 ~ 96 %)。3 -苯基丙酸苯酯以42 %的收率( E / Z = 1∶1.2)脱氢。
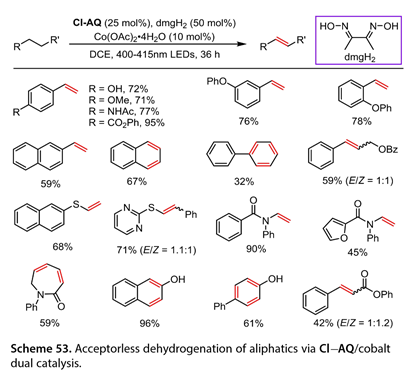
图53. 通过Cl-AQ /钴双催化实现脂肪烃的无受体脱氢
该催化脂肪底物脱氢反应的详细机理如图54所示。激发态的Cl-AQ ( Cl-AQ * )与脂肪族底物之间的HAT可以得到烷基自由基( 106 )和[ Cl-AQ-H] *。前者被钴肟配合物( 107 )捕获,得到[ CoⅢ] -烷基化合物( 108 )。随后,在光照下,108可以发生均裂[ CoⅢ] -烷基键的均裂和钴介导的β - H原子抽提,生成目标产物和Co (Ⅲ)氢化物( 109 )。生成的(109)随后氧化[ Cl-AQ-H] *形成Co ( II ) H ( 110 )和质子化的Cl-AQ ( 111 )。最后,(111)足够酸性质子化(110)生成(107)和Cl-AQ,同时释放H2,从而完成催化循环。
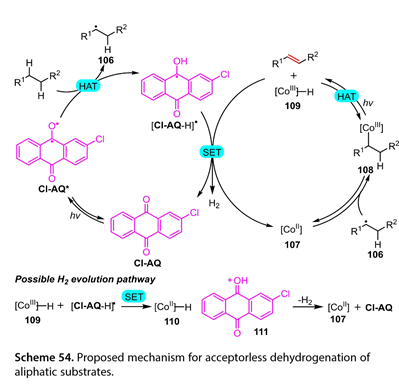
图54. 提出了脂肪族底物无受体脱氢的机理
15. C(sp3)-H氧杂环的官能化
Kong课题组[36]公开了一种利用( 4 -甲氧基苯基) ( 4- (三氟甲基)苯基)甲酮( CF3-OME-BP)和镍双催化体系,在10 W 390 nm LEDs照射下对氧杂环进行对映选择性C(sp3)-H官能化的方法( 图 55 )。芳基溴化物与酯或对位苯环上的氟反应,以67 - 75 %的产率和88 - 90 %的ee值得到目标产物。电子中性的芳基溴化物4 -溴- 1,1 ' -联苯也能以61 %的产率得到88 %的ee值。4 -溴- 2 -氯- 1 -氟苯与四氢呋喃反应得到了69 %的产率和88 %的ee值。
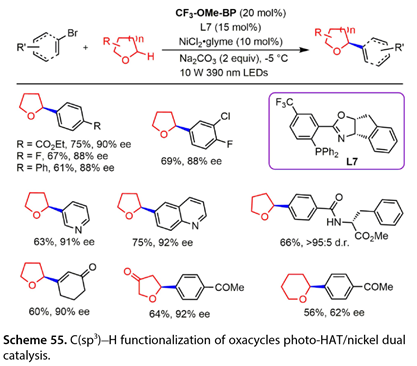
图55. 氧杂环C(sp3)-H官能化的光- HAT /镍双催化
该光催化反应与3 -溴吡啶或6 -溴喹啉的光催化反应同样成功,产率为63 - 75 % ( 91 ~ 92 % ee)。一个复杂分子衍生的芳基溴化物是该反应的活性底物。用四氢呋喃处理活化的烯基溴化物,如3 -溴环己- 2 -烯- 1 -酮,以60 %的产率和90 %的ee值得到了预期的产物。最后,使用四氢呋喃- 3 -酮和氧杂环己烷分别以64 % ( 92 % ee )和56 % ( 62 % ee )的产率得到相应的产物。
基于密度泛函理论计算,发展了一种可能的机理( 图 56 )。用10 W 390 nm的LED照射CF3-OME-BP形成的激发态CF3-OME-BP ( CF3-OME-BP*),可以提取无水乙醇。H原子从四氢呋喃中生成以碳为中心的自由基( 112 )和[CF3-OME-BP-H] *。L-NiII-Cl2 ( 113 )再氧化[CF3-OME-BP-H] *得到[CF3-OME-BP]和L - NiI-Cl ( 114 )。中间体(114)可以捕获(112)生成Ni ( II )(115)。(115)和[ CF3-OME-BP-H] *之间的SET导致形成Ni ( I ) (116),并再生CF3-OME-BP。1- ( 4 -溴苯基)乙酮氧化加成(116)得到Ni ( III )(117),再经还原消除得到目标产物和L - NiI-Br ( 118 )。
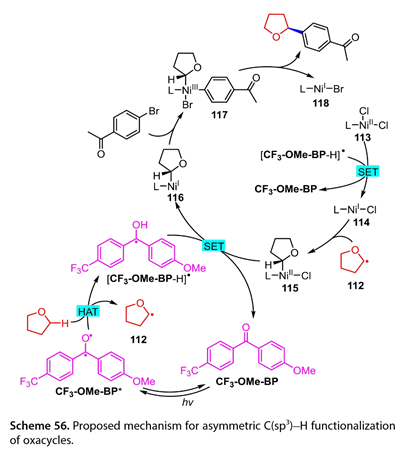
图56. 提出了恶环不对称C(sp3)-H官能化的机理
16.α -氨基C(sp3)-H的烷基化
2021年,Vincent和图莱克等人[37]报道了Cu (Ⅱ)配合物( CuⅡ- 1 )催化的N -烷基苯胺的直接C(sp3)-H烷基化反应,该反应结合了铜催化剂和二苯甲酮光催化剂( 图57 )。在365 nm光照下,丙烯酸酯、4 -乙烯基吡啶和环己- 2 -烯- 1 -酮等一系列Michael受体与N,N -二甲基苯胺反应,得到了一系列的烃基化产物(收率46 ~ 91 %)。4 -位含氰基或甲基的N,N -二甲基苯胺与丙烯酸乙酯反应可以以80 - 92 %的产率得到目标产物。值得注意的是,N,N -二甲基吡啶- 4 -胺的反应产率为56 %。用CN基团或1 -苯基哌啶取代N -甲基苯胺,以45 - 71 %的收率得到目标产物。
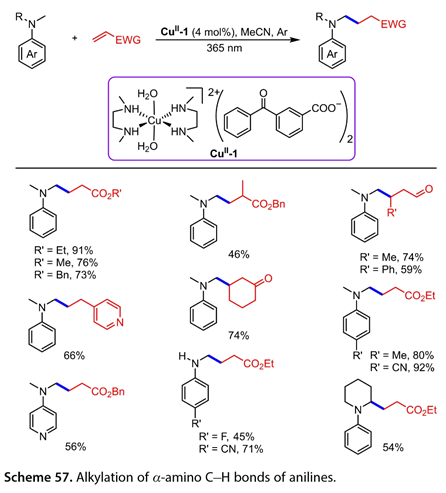
图57. 苯胺的α -氨基C-H键的烷基化
我们提出了N -烷基苯胺直接C(sp3)-H烷基化反应的机理( 图 58 )。激发态的BPCO2 ( 3BPCO2 )可以氧化苯胺得到[ BPCO2 ] *和苯胺自由基阳离子( 119 )。(119)和[ BPCO2 ] *之间的质子转移产生自由基( 120 )和[ BPHCO2 ] *。随后,(120)被烯烃捕获得到亲电自由基( 121 )。同时,[ BPCO2 ] *或[ BPHCO2 ] *可以将CuⅡ或CuⅠ物种还原为CuⅠ或Cu0,同时再生BPCO2的基态。前者与(121)反应,生成目标产物。
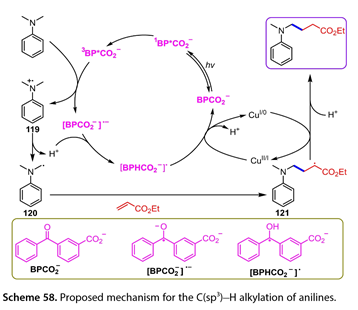
图58. 提出了苯胺的C(sp3)-H烷基化反应机理
17.总结与展望
本文综述了近年来羰基-光氧化还原/金属双催化体系在构建碳-碳键和碳-杂原子键方面的研究进展。羰基光催化剂有效地充当了单电子反式-Fer试剂,能量转移试剂或氢原子转移试剂促进金属催化的酰化,硼化,环化,磺酰化,苄位C-H三氟甲基化,炔基化,膦酰化,芳基卤化物的酯化和醚化,脂肪烃的脱氢,氧杂环的C(sp3)-H官能化,α-氨基C-H键的烷基化,烯烃的氢酰化和三组分烯烃加成。特别值得注意的是,发展了C(sp3)-H的叠氮化或不对称苄位C-H氰化的方法,涉及电光化学氧化和铜/锰催化的组合。尽管在该领域已经取得了许多进展,但仍然存在一些挑战,包括开发新的、高效的光催化剂、改造更具挑战性的偶联伙伴、立体选择性不对称反应、使用环境友好的溶剂和合成先进的药物成分。我们预期,羰基-光氧化还原/金属双催化将成为一种通用的、高效的策略,在实验室和工业规模上构建复杂分子具有广泛的吸引力。








 客服QQ
客服QQ